ある症例:
62歳男性が、2日前から急性発症の右目の視力低下で来院した。右目の全方向の眼球運動障害があり、眼底には特記すべき所見がなく、眼窩先端症候群が疑われた。
頭部CT/MRIが実施され、石灰化を伴う蝶形骨洞炎が指摘された。真菌性副鼻腔炎を鑑別に挙げて抗真菌薬でエンピリック治療を行うことは妥当だろうか?
本題:
結論として上記症例は、真菌性副鼻腔炎の臨床像ではなく治療適応はないと判断したのですが、そもそも石灰化で真菌性の鑑別ができるということを聞いたことがなかったので、副鼻腔炎の画像診断の総説をいくつかを読んでみたところ、かなり勉強になったので備忘録的にサマライズしておきます。
眼科先端症候群は膠原病内科でも良く出会う疾患なので、真菌性副鼻腔炎の典型的な画像パターンを知っておくと、何かの役に立ちそうです(たぶんね)。
先に結論を書くと、
- アスペルギルス副鼻腔炎は石灰化が高頻度だが、非真菌性も低頻度で石灰化は見られる
- 真菌性の石灰化パターンは中心型、細粒状
- 非真菌性の石灰化パターンは周辺型、円形・卵殻状
- 結節状、線状の石灰化はどちらにも見られる
AJNR Am J Neuroradiol. 1999 Apr;20(4):571-4.
方法
- 510名の副鼻腔手術を受けた慢性上顎洞炎の後ろ向きコホート
- そのうち副鼻腔内石灰化を認めた36名のCT画像と病理を解析した
- 原因微生物は手術的に採取された検体により診断された
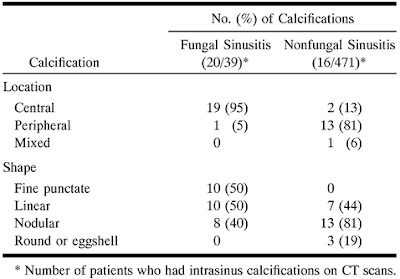
- 石灰化は、細粒状、線状、結節状、円形・卵殻状の4カテゴリーに分類
- さらに上顎洞内の位置で、周辺型、中心型、混合型に分類
結果
- 510名中、39名が真菌性、471名が非真菌性
- 石灰化は、真菌性で20名 (51%)、非真菌性で16名 (3%) に認められた
- 石灰化を認めた真菌性副鼻腔炎の全ての原因微生物はアスペルギルスだった
- 真菌性の石灰化部位は95%が中心型、非真菌性では81%が周辺型だった
アスペルギルス副鼻腔炎における結節状(太矢印)と細粒状石灰化(細矢印)
アスペルギルス副鼻腔炎における線状石灰化(細矢印)
非真菌性副鼻腔炎の円形・卵殻状石灰化
病理との対比で、真菌性の石灰化は、菌糸の壊死領域内のリン酸カルシウムの沈着と考えられているようです。そのため壊死した中心部に位置し、初期には細粒状となるが、カルシウム沈着が進行すると密になった石灰化が線状あるいは結節状に見えるということのようです。
非真菌性の石灰化は、慢性炎症によって生じた萎縮性石灰化と考えられており(動脈硬化的な?)、このプロセスは副鼻腔の肥厚した粘膜層付近で起きることから、粘膜に該当する周辺部に位置し、それが密になると線状あるいは結節状に見えるということみたいです。
円形・卵殻状の石灰化は石灰沈着ではなく、病理学的には骨化のようで、やはりこれも慢性炎症に伴うものと考えて良いようです。
ちなみに石灰化はカルシウム塩の沈着、骨化はハイドロキシアパタイトの沈着、とのことです(知らなかった)。
今回の症例の石灰化はキレイな卵殻状だったので、この点も非真菌性を示唆する所見とわかりました。